Характеристика атома алюминия
Строение атома алюминия (Al), схема и примеры
Онлайн калькуляторыНа нашем сайте собрано более 100 бесплатных онлайн калькуляторов по математике, геометрии и физике.
СправочникОсновные формулы, таблицы и теоремы для учащихся. Все что нужно, чтобы сделать домашнее задание!
Заказать решениеНе можете решить контрольную?! Мы поможем! Более 20 000 авторов выполнят вашу работу от 100 руб!
Металл. Обозначение – Al. Порядковый номер – 13. Относительная атомная масса – 26,981 а.е.м.
Электронное строение атома алюминия
Атом алюминия состоит из положительно заряженного ядра (+13), внутри которого находится 13 протонов и 14 нейтронов. Ядро окружено тремя оболочками, по которым движутся 13 электронов.
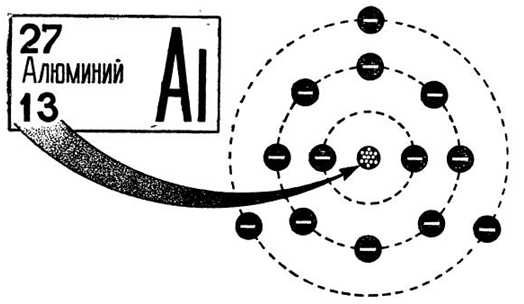
Рис. 1. Схематическое изображение строения атома алюминия.
Распределение электронов по орбиталям выглядит следующим образом:
+13Al)2)8)3;
1s22s22p63s23p1.
На внешнем энергетическом уровне алюминия находится три электрона, все электроны 3-го подуровня. Энергетическая диаграмма принимает следующий вид:
Теоретически возможно возбужденное состояние для атома алюминия за счет наличия вакантной 3d-орбитали. Однако распаривания электронов 3s-подуровня на деле не происходит.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |
ru.solverbook.com
Строение атома алюминия
Алюминий (Al) – лёгкий металл, занимающий третье место по распространённости в земной коре среди химических элементов. Строение атома алюминия позволяет легко обрабатывать металл: он поддаётся литью, формовке, механическому воздействию.
Электронное строение атома элемента алюминия связано с его положением в периодической таблице Менделеева. Алюминий имеет 13 порядковый номер и находится в третьем периоде, в IIIa группе. Относительная атомная масса алюминия – 27. Электронная конфигурация атома алюминия – 1s22s22p63s23p1, модель распределения электронов – +13Al)2)8)3.
Рис. 1. Алюминий в периодической таблице.
Атом элемента состоит из положительно заряженного ядра +13 (13 протонов и 14 нейронов) и трёх электронных оболочек с 13 электронами. На внешнем энергетическом уровне находится всего три электрона. В возбуждённом состоянии атом способен отдавать все три электрона, проявляя степень окисления +3, или образовывать три ковалентные связи. Поэтому алюминий имеет третью валентность.
Рис. 2. Строение атома алюминия.
В природе алюминий встречается только в составе соединений – глины, слюды, корунда. Металл ценился дороже золота до открытия промышленного способа его получения.
Алюминий – серебристый металл, обладающий высокой электропроводностью и пластичностью. Элемент при комнатной температуре легко соединяется с кислородом, образуя на поверхности оксидную плёнку, защищающую металл от коррозии. Образование плёнки препятствует реакции с водой, концентрированными азотной и серной кислотами, поэтому алюминиевая тара подходит для перевозки этих кислот.
Рис. 3. Оксид алюминия.
Для снятия оксидной плёнки используют соли аммония, горячие щёлочи, сплавы ртути. После разрушения оксидной плёнки алюминий вступает в реакцию со многими неметаллами и соединениями. Основные химические свойства элемента описаны в таблице.
| Взаимодействие | Ход реакции | Пример |
| С водой | Только в условиях отсутствия оксидной плёнки. Образуется гидроксид алюминия | 2Al + 6h3O → 2Al(OH)3 + 3h3 |
| С кислородом | Образуется оксид алюминия | 4Al + 3O2 → 2Al2O3 + Q |
| С галогенами | При комнатной температуре. С йодом – в присутствии катализатора | 2Al + 3Cl2 → 2AlCl3 |
| С серой | При температуре выше 200°С, образуется сульфид алюминия | 2Al + 3S → Al2S3 |
| С фосфором | При температуре 500°С, образуется фосфид алюминия | Al + P → AlP |
| С азотом | При температуре 800°С, образуется нитрид алюминия | 2Al + N2 → 2AlN |
| С углеродом | При температуре 2000°С, образуется карбид алюминия | 4Al + 3C → Al4C3 |
| С кислотами | При комнатной температуре реагирует с разбавленными кислотами, при нагревании – с концентрированными. Образуются соли |
– 2Al + 3h3SO4 → Al2(SO4)3 + 3h3; – 2Al + 6HCl → 2AlCl3 + 3h3; – Al + 6HNO3(конц.) → Al(NO3)3 + 3NO2 + 3h3O |
| Со щелочами | Реагируют растворы и сплавы | – 2Al + 2NaOH + 10h3O → 2Na[Al(h3O)2(OH)4] + 3h3; – 2Al + 6KOH → 2KAlO2 + 2K2O + 3h3 |
| С оксидами | Вытесняет металлы | 2Al + Cr2O3 = 2Cr + Al2O3 |
Алюминий не взаимодействует с водородом.
Атом алюминия включает 13 электронов. Схема строения алюминия – 1s22s22p63s23p1. На внешнем уровне находится три электрона, определяющие третью валентность элемента. Алюминий – лёгкий, плавкий металл, легко вступающий в реакцию с кислородом и образующий на поверхности оксидную плёнку. Благодаря плёнке металл не подвержен коррозии и не вступает в реакцию с концентрированными кислотами. При комнатной температуре алюминий реагирует с галогенами, при нагревании – с серой, фосфором, азотом, углеродом.
Средняя оценка: 4.6. Всего получено оценок: 117.
obrazovaka.ru
Мир науки
Алюминий - металлический элемент главной подгруппы III группы 3 периода периодической системы химических элементов. Электронная конфигурация внешнего энергетического уровня его атома 3s23p1. При химических взаимодействиях в возбужденном состоянии он способен образовывать три ковалентных связи
или полностью отдавать свои три электрона, проявляя в своих соединениях степень окисления +3. Итак, Алюминий является активным восстановителем.Алюминий по распространенности занимает третье место среди других элементов. Массовая доля алюминия в земной коре составляет 8,5%. В природе он встречается только в виде соединений. Он входит в состав алюмосиликатов, к которым относятся: глины, слюды, полевые шпаты, в частности каолин. Промышленно важным алюминиевой рудой являются боксит Al2O3 • nН2О. Алюминий входит в состав минерала корунда, который является кристаллическим алюминий оксидом Al2O3. Различные примеси способны оказывать корундовые разных цветов. зеленого, желтого, оранжевого, фиолетового и других цветов и оттенков. Его синяя разновидность называют сапфиром, а красный - рубином. И рубины, и сапфиры являются драгоценными камнями.Простое вещество алюминий - блестящий серебристо-белый металл. Он обладает высокой способностью отражать световые и тепловые лучи, а также высокие тепло-и электропроводность. Температура плавления алюминия 660 ° С. Это достаточно легкий и пластичный металл. Из него можно производить тонкую проволоку и фольгу.Химически алюминий очень активен. На воздухе он быстро окисляется и покрывается тонкой пленкой алюминий оксида. Оксидная пленка является достаточно прочной и вызывает коррозионную стойкость алюминия. При нагревании на воздухе или в кислороде алюминий сгорает, образуя также алюминий оксид:4Al + 3O2 = 2Al2O3.Алюминий активно реагирует с другими неметаллами. При обычных условиях он взаимодействует с хлором и бромом, образуя соли, например, алюминий хлорид:2Al + 3Сl2 = 2AlСl3.Реакция алюминия с йодом происходит, если в смеси алюминиевого порошка с йодом добавить несколько капель воды, которая выполняет роль катализатора:2Al + 3I2 = 2AlИ3.При нагревании алюминий реагирует с серой, азотом, углеродом, например:2Al + 3S = Al2S3.В обычном состоянии алюминий покрыт защитной оксидной пленкой и является устойчивым к действию воды даже при нагревании. Если пленка алюминий оксида будет разрушена, то алюминий будет активно реагировать с водой с выделением газообразного водорода:2Al + 6Н2О = 2Al (OH) 3 ? + 3Н2 ?.Алюминий реагирует с растворами кислот с образованием солей и водорода, например:2Al + 6НСl = 2AlCl3 + 3Н2 ?.Концентрированные серная и нитратная кислоты пассивируют алюминий, т.е. увеличивают прочность оксидной пленки. Таким образом, алюминий с ними не реагирует.Оксидная пленка легко растворяется в щелочах и алюминий реагирует с растворами щелочей с выделением водорода:2Al + 2NaOH +6 Н2O = 2Na [Al (OH) 4] + 3Н2 ?.Алюминий восстанавливает металлы из их оксидов при нагревании (Алюминотермия), например:Fe2O3 + 2Al = 2Fe + Al2O3.Алюминий добывают путем электролиза глинозема растворенного в расплавленном криолите Na3 [AlF6].
Широкое применение алюминия обусловлено его свойствами. Сочетание легкости с достаточно высокой электропроводностью позволяет применять алюминий как проводник электрического тока. Алюминий и его сплавы используют практически во всех областях современной техники: в авиационной и автомобильной промышленности, железнодорожном и водном транспорте, машиностроении и т.д.. Благодаря высокой коррозионной стойкости алюминий широко применяют при изготовлении аппаратуры для производства пищевых продуктов и некоторых химических веществ. Из полированного алюминия изготовляют зеркала и поверхности нагревательных и осветительных рефлекторов. Алюминий используется как розкисник сталей и других сплавов. Им восстанавливают металлы из их оксидов.
worldofscience.ru
Алюминий: строение атома, распространение в природе. Физические и химические свойства алюминия. Применение алюминия
Алюминий: строение атома, распространение в природе. Физические и химические свойства алюминия. Применение алюминия
Алюминий - металлический элемент главной подгруппы III группы 3 периода периодической системы химических элементов. Электронная конфигурация внешнего энергетического уровня его атома 3s23p1. При химических взаимодействиях в возбужденном состоянии он способен образовывать три ковалентных связи или полностью отдавать свои три электроны, проявляя в своих соединениях степень окисления +3. Следовательно, Алюминий является активным восстановителем.
Алюминий по распространенности занимает третье место среди других элементов. Массовая доля Алюминия в земной коре составляет 8,5 %. В природе он встречается только в виде соединений. Он входит в состав алюмосиликатов, к которым относятся: глины, слюды, полевые шпаты, в частности каолин. Промышленно важным алюминиевой рудой являются боксит Al2O3 · nН2О. Алюминий входит в состав минерала корунда, который является кристаллическим алюминий оксидом Al2O3. Различные примеси способны оказывать корундовые разных цветов. зеленого, желтого, оранжевого, фиолетового и других цветов и оттенков. Его синий разновидность называют сапфиром, а красный - рубином. И рубины, и сапфиры являются драгоценными камнями.
Простое вещество алюминий - блестящий серебристо-белый металл. Он имеет высокую способность отражать световые и тепловые лучи, а также высокие тепло - и электропроводность. Температура плавления алюминия 660 °С. Это достаточно легкий и пластичный металл. С него можно производить тонкую проволоку и фольгу.
Химически алюминий очень активный. На воздухе он быстро окисляется и покрывается тонкой пленкой алюминий оксида. Оксидная пленка является достаточно прочной и предопределяет коррозионную стойкость алюминия. При нагревании на воздухе или в кислороде алюминий сгорает, образуя также алюминий оксид:
4Al + 3O2 = 2Al2O3.
Алюминий активно реагирует с другими неметаллами. При обычных условиях он взаимодействует с хлором и бромом, образуя соли, например, алюминий хлорид:
2Al + 3Сl2 = 2AlСl3.
Реакция алюминия с йодом происходит, если к смеси алюминиевого порошка с йодом добавить несколько капель воды, которая выполняет роль катализатора:
2Al + 3I2 = 2AlІ3.
При нагревании алюминий реагирует с серой, азотом, углеродом, например:
2Al + 3S = Al2S3.
В обычном состоянии алюминий покрыт защитной оксидной пленкой и является устойчивым к воздействию воды даже при нагревании. Если пленка алюминий оксида будет разрушена, то алюминий будет активно реагировать с водой с выделением газуватого водорода:
2Al + 6Н2О = 2Al(ОН)3↓ + 3Н2↑.
Алюминий реагирует с растворами кислот с образованием солей и водорода, например:
2Al + 6НСl= 2AlCl3 + 3Н2↑.
Концентрированные сульфатная и азотная кислоты пассивируют алюминий, то есть увеличивают прочность оксидной пленки. Таким образом, алюминий с ними не реагирует.
Оксидная пленка легко растворяется в щелочах и алюминий реагирует с растворами щелочей с выделением водорода:
2Al + 2NaOH +6Н2O = 2Na[Al(OH)4] + 3Н2↑.
Алюминий восстанавливает металлы из их оксидов при нагревании (алюмінотермія), например:
Fe2O3 + 2Al = 2Fe + Al2O3.
Алюминий добывают путем электролиза глинозема, растворенного в расплавленном криолите Na3[AlF6].
Широкое применение алюминия обусловлено его свойствами. Сочетание легкости с достаточно высокой электропроводностью позволяет применять алюминий как проводник электрического тока. Алюминий и его сплавы используют практически во всех областях современной техники: в авиационной и автомобильной промышленности, железнодорожном и водном транспорте, машиностроении и т.п. Благодаря высокой коррозионной стойкости алюминий широко применяют при изготовлении аппаратуры для производства пищевых продуктов и некоторых химических веществ. Из полированного алюминия изготавливают зеркала и поверхности нагревательных и осветительных рефлекторов. Алюминий используют как розкисник сталей и других сплавов. Им восстанавливают металлы из их оксидов.
na-uroke.in.ua










