Характеристика элемента алюминий
Алюминий. Свойства алюминия. Применение алюминия
Алюминий в чистом виде впервые выделен Фридрихом Велером. Немецкий химик нагрел безводный хлорид элемента с металлическим калием. Произошло это во 2-ой половине 19-го века. До 20-го столетия кг алюминия стоил дороже золота.
Новый металл позволяли себе лишь богачи и государственные музеи. Причина высокой стоимости – сложность отделения алюминия от других веществ. Метод добычи элемента в промышленных масштабах предложил Чарльз Холл.
В 1886-ом году он растворил оксид алюминия в расплаве криолита. Немец заключил смесь в гранитный сосуд и подключил к нему электрический ток. На дно емкости осели бляшки чистого металла.
Химические и физические свойства алюминия
Какой алюминий? Серебристо-белый, блестящий. Поэтому, Фридрих Велер сравнивал полученные им гранулы металла с серебром. Но, была оговорка, — алюминий значительно легче.
Пластичность же приближена к драгоценным серебру и золоту. Алюминий – вещество, без проблем вытягивающееся в тонкую проволоку и листы. Достаточно вспомнить фольгу. Она делается на основе 13-го элемента.
Алюминий легок за счет небольшой плотности. Она втрое меньше, чем у меди и железа. При этом в прочности 13-ый элемент почти не уступает.
Такое сочетание сделало серебристый металл незаменимым в промышленности, к примеру, производстве деталей для автомобилей. Речь идет и о кустарном производстве, ведь сварка алюминия возможна даже в домашних условиях.
Формула алюминия позволяет активно отражать световые, но и тепловые лучи. Высока и электропроводность элемента. Главное, излишне не нагревать его. При 660-ти градусах расплавится. Поднимись температура чуть выше – сгорит.
Металл исчезнет, останется лишь оксид алюминия. Он образуется и в стандартных условиях, но лишь в виде поверхностной пленки. Она защищает металл. Поэтому, он неплохо противостоит коррозии, ведь доступ кислорода блокирован.
Оксидная пленка защищает металл и от воды. Если удалить с поверхности алюминия налет, запустится реакция с Н2О. Выделение газов водорода произойдет даже при комнатной температуре. Так что, алюминиевая лодка не превращается в дым лишь за счет оксидной пленки и защитной краски, нанесенной на корпус судна.
Наиболее активно взаимодействие алюминия с неметаллами. Реакции с бромом и хлором проходят даже при обычны условиях. В итоге, образуются соли алюминия. Соли водорода получаются, если соединить 13-ый элемент с растворами кислот. Реакция состоится и со щелочами, но лишь после удаления оксидной пленки. Выделится чистый водород.
Применение алюминия
Металл напыляют на зеркала. Пригождаются высокие показатели отражения света. Процесс проходит в условиях вакуума. Изготавливают не только стандартные зеркала, но предметы с зеркальными поверхностями. Таковыми становятся: керамическая плитка, бытовая техника, светильники.
Дуэт алюминий-медь – основа сплава дюралюминий. Попросту его называют дюраль. В качестве лигатуры добавляют магний. Состав прочнее чистого алюминия в 7 раз, поэтому, подходит для области машиностроения и авиаконструирования.
Медь придает 13-му элементу прочность, но не тяжесть. Дюраль остается в 3 раза легче железа. Небольшая масса алюминия – залог легкости авто, самолетов, кораблей. Это упрощает перевозку, эксплуатацию, снижает цену продукции.
Купить алюминий автопромышленники стремятся еще и потому, что на его сплавы легко наносятся защитные и декоративные составы. Краска ложится быстрее и ровнее, чем на сталь, пластик.
При этом, сплавы податливы, просто обрабатываются. Это ценно, учитывая массу изгибов и конструктивных переходов на современных моделях автомобилей.
13-ый элемент не только легко красится, но и сам может выступать в роли красителя. В текстильной промышленности закупается сульфат алюминия. Он же пригождается в печатном деле, где требуются нерастворимые пигменты.
Интересно, что раствор сульфата алюминия применяют еще и для очистки воды. В присутствии «агента» вредные примеси выпадают в осадок, нейтрализуются.
Нейтрализует 13-ый элемент и кислоты. Особенно хорошо с этой ролью справляется гидроксид алюминия. Его ценят в фармакологии, медицине, добавляя в лекарства от изжоги.
Выписывают гидроксид и при язвах, воспалительных процессах кишечного тракта. Так что в аптечных препарата тоже есть алюминий. Кислота в желудке – повод узнать о таких лекарствах побольше.
В СССР и бронзы с 11-процентной добавкой алюминия чеканили монеты. Достоинство знаков – 1, 2 и 5 копеек. Начали выпускать в 1926-ом, закончили в 1957-ом году. А вот производство алюминиевых банок для консервов не прекратили.
Тушенку, сайру и прочие завтраки туристов до си пор упаковывают в тару на основе 13-го элемента. Такие банки не вступают в реакцию с продуктами питания, при этом, легки и дешевы.
Порошок алюминия входит в состав многих взрывчатых смесей, в том числе и пиротехники. В промышленности применяют подрывные механизмы на основе тринитротолуола и измельченного 13-го элемента. Мощная взрывчатка получается и при добавлении к алюминию аммиачной селитры.
В нефтяной отрасли необходим хлорид алюминия. Он играет роль катализатора при разложении органики на фракции. У нефти есть свойство выделять газообразные, легкие углеводороды бензинового типа, взаимодействуя с хлоридом 13-го металла. Реагент должен быть безводным. После добавления хлорида, смесь прогревают до 280-ти градусов Цельсия.
В строительстве нередко смешиваю натрий и алюминий. Получается присадка к бетону. Алюминат натрия ускоряет его затвердение за счет убыстрения гидратации.
Повышается скорость микрокристаллизации, значит, увеличивается прочность и твердость бетона. К тому же, алюминат натрия спасает арматуру, уложенную в раствор, от коррозии.
Добыча алюминия
Металл замыкает тройку самых распространенных на земле. Это объясняет его доступность и широкое применение. Однако, в чистом виде природа элемент человеку не дает. Алюминий приходится выделять из различных соединений. Больше всего 13-го элемента в бокситах. Это глиноподобные породы, сосредоточенные, в основном, в тропическом поясе.
Бокситы дробят, потом сушат, снова дробят и перемалывают в присутствии небольшого объема воды. Получается густая масса. Ее нагревают паром. При этом большая часть кремния, коим бокситы тоже не бедны, испаряется. Остается оксид 13-го металла.
Его помещают в промышленные ванны. В них уже находится расплавленный криолит. Температура держится на отметке 950 градусов Цельсия. Нужен и электрический ток силой минимум в 400 кА. То есть, используется электролиз, как и 200 лет назад, когда элемент выделял Чарльз Холл.
Проходя через раскаленный раствор, ток разрывает связи между металлом и кислородом. В итоге, на дне ванн остается чистый алюминий. Реакции окончены. Завершает процесс отливание из осадка слитков и их отправка потребителю, или же, использование для формирования различных сплавов.
Основные производства алюминия находятся там же, где и залежи бокситов. В передовика – Гвинея. В ее недрах скрыто почти 8 000 000 тонн 13-го элемента. На 2-ом месте Австралия с показателем в 6 000 000. В Бразилии алюминия уже в 2 раза меньше. Общемировые же запасы оцениваются в 29 000 000 тонн.
Цена алюминия
За тонну алюминия просят почти 1 500 долларов США. Таковы данные бирж цветных металлов на 20 января 2016-го. Стоимость устанавливается, в основном, промышленниками. Точнее, на цену алюминия влияет их спрос на сырье. Влияет на запросы поставщиков и стоимость электроэнергии, ведь производство 13-го элемента энергоемко.
Иные цены установлены на лом алюминия. Он идет на переплавку. Стоимость оглашается за килограмм, причем, имеет значение характер сдаваемого материала.
Так, за электротехнический металл дают примерно 70 рублей. За пищевой алюминий можно получить на 5-10 рублей меньше. Столько же платят за моторный металл. Если сдается разносортица, ее цена – 50-55 рублей за килограмм.
Самый дешевый вид лома – стружка алюминия. За нее удается выручить лишь 15-20 рублей. Чуть больше дадут за банки из 13-го элемента. Имеется в виду тара из-под напитков, консервов.
Невысоко ценят и алюминиевые радиаторы. Цена за килограмм лома – около 30-ти рублей. Это усредненные показатели. В разных регионах, на разных точках алюминий принимают дороже, либо дешевле. Нередко стоимость материалов зависит от сдаваемых объемов.
tvoi-uvelirr.ru
Физические и химические свойства алюминия
Атомная масса – 27 а.е.м. Электронная конфигурация внешнего энергетического уровня – 3s23p1. В своих соединениях алюминий проявляет степень окисления равную «+3».
Химические свойства алюминия
Алюминий в реакциях проявляет восстановительные свойства. Поскольку при пребывании на воздухе на его поверхности образуется оксидная пленка, устойчив к взаимодействию с другими веществами. Например, алюминий пассивируется в воде, концентрированной азотной кислоте и растворе дихромата калия. Однако, после удаления с его поверхности оксидной пленки способен взаимодействовать с простыми веществами. Большинство реакций протекает при нагревании:
2Alpowder +3/2O2 = Al2O3;
2Al + 3F2 = 2AlF3 (t);
2Alpowder + 3Hal2 = 2AlHal3 (t = 25C);
2Al + N2 = 2AlN (t);
2Al +3S = Al2S3 (t);
4Al + 3Cgraphite = Al4C3 (t);
4Al + P4 = 4AlP (t, в атмосфере Н2).
Также, алюминий после удаления с его поверхности оксидной пленки способен взаимодействовать с водой с образованием гидроксида:
2Al + 6h3O = 2Al(OH)3 +3h3↑.
Алюминий проявляет амфотерные свойства, поэтому он способен растворяться в разбавленных растворах кислот и щелочах:
2Al + 3h3SO4(dilute) = Al2(SO4)3 + 3h3↑;
2Al + 6HCldilute = 2AlCl3 + 3 h3↑;
8Al + 30HNO3(dilute) = 8Al(NO3)3 + 3N2O↑ + 15h3O;
2Al +2NaOH +3h3O = 2Na[Al(OH)4] + 3h3↑;
2Al + 2(NaOH×h3O) = 2NaAlO2 + 3 h3↑.
Алюмиотермия – способ получения металлов из их оксидов, основанный на восстановлении этих металлов алюминием:
8Al + 3Fe3O4 = 4Al2O3 + 9Fe;
2Al + Cr2O3 = Al2O3 +2Cr.
Физические свойства алюминия
Алюминий представляет собой серебристо-белого цвета. Основные физические свойства алюминия – легкость, высокая тепло- и электропроводность. В свободном состоянии при пребывании на воздухе алюминий покрывается прочной пленкой оксида Al2O3, которая делает его устойчивым к действию концентрированных кислот. Температура плавления – 660,37С, кипения – 2500С.
Получение и применение алюминия
Алюминий получают электролизом расплава оксида этого элемента:
2Al2O3 = 4Al + 3O2↑
Однако из-за небольшого выхода продукта, чаще используют способ получения алюминия электролизом смеси Na3[AlF6] и Al2O3. Реакция протекает при нагревании до 960С и в присутствии катализаторов – фторидов (AlF3, CaF2 и др.), при этом на выделение алюминия происходит на катоде, а на аноде выделяется кислород.
Алюминий нашел широкое применение в промышленности, так, сплавы на основе алюминия – основные конструкционные материалы в самолето- и судостроении.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |
ru.solverbook.com
Ответы@Mail.Ru: Характеристика химических свойств алюминия. Химия
АЛЮМ˜ИНИЙ (лат. Aluminium), Al (читается «алюминий») , химический элемент с атомным номером 13, атомная масса 26,98154. Природный алюминий состоит из одного нуклида 27Al. Расположен в третьем периоде в группе IIIA периодической системы элементов Менделеева. Конфигурация внешнего электронного слоя 3 s 2 p1. Практически во всех соединениях степень окисления алюминия +3 (валентность III). Алюминий — типичный металл, кристаллическая решетка кубическая гранецентрированная, параметр а = 0,40403 нм. Температура плавления чистого металла 660 °C, температура кипения около 2450 °C, плотность 2,6989 г/см3. Температурный коэффициент линейного расширения алюминия около 2,5·10-5 К-1. Стандартный электродный потенциал Al3+/Al –1,663В. Химически алюминий — довольно активный металл. На воздухе его поверхность мгновенно покрывается плотной пленкой оксида Al2О3, которая препятствует дальнейшему доступу кислорода к металлу и приводит к прекращению реакции, что обусловливает высокие антикоррозионные свойства алюминия. Защитная поверхностная пленка на алюминии образуется также, если его поместить в концентрированную азотную кислоту. С остальными кислотами алюминий активно реагирует: 6НСl + 2Al = 2AlCl3 + 3h3, 3Н2SO4 + 2Al = Al2(SO4)3 + 3h3. Алюминий реагирует с растворами щелочей. Сначала растворяется защитная оксидная пленка: Al2О3 + 2NaOH + 3h3O = 2Na[Al(OH)4]. Затем протекают реакции: 2Al + 6h3O = 2Al(OH)3 + 3h3, NaOH + Al(OH)3 = Na[Al(OH)4], или суммарно: 2Al + 6h3O + 2NaOH = Na[Al(OH)4] + 3Н2, и в результате образуются алюминаты: Na[Al(OH)4] — алюминат натрия (тетрагидроксоалюминат натрия) , К [Al(OH)4] — алюминат калия (терагидроксоалюминат калия) или др. Так как для атома алюминия в этих соединениях характерно координационное число 6, а не 4, то действительные формулы указанных тетрагидроксосоединений следующие: Na[Al(OH)4(Н2О) 2] и К [Al(OH)4(Н2О) 2]. При нагревании алюминий реагирует с галогенами: 2Al + 3Cl2 = 2AlCl3, 2Al + 3 Br2 = 2AlBr3. Интересно, что реакция между порошками алюминия и иода начинается при комнатной температуре, если в исходную смесь добавить несколько капель воды, которая в данном случае играет роль катализатора: 2Al + 3I2 = 2AlI3. Взаимодействие алюминия с серой при нагревании приводит к образованию сульфида алюминия: 2Al + 3S = Al2S3, который легко разлагается водой: Al2S3 + 6Н2О = 2Al(ОН) 3 + 3Н2S. С водородом алюминий непосредственно не взаимодействует, однако косвенными путями, например, с использованием алюминийорганических соединений, можно синтезировать твердый полимерный гидрид алюминия (AlН3)х — сильнейший восстановитель. В виде порошка алюминий можно сжечь на воздухе, причем образуется белый тугоплавкий порошок оксида алюминия Al2О3. Высокая прочность связи в Al2О3 обусловливает большую теплоту его образования из простых веществ и способность алюминия восстанавливать многие металлы из их оксидов, например: 3Fe3O4 + 8Al = 4Al2O3 + 9Fe и даже 3СаО + 2Al = Al2О3 + 3Са. Такой способ получения металлов называют алюминотермией. Амфотерному оксиду Al2О3 соответствует амфотерный гидроксид — аморфное полимерное соединение, не имеющее постоянного состава. Состав гидроксида алюминия может быть передан формулой xAl2O3·yh3O, при изучении химии в школе формулу гидроксида алюминия чаще всего указывают как Аl(OH)3. В лаборатории гидроксид алюминия можно получить в виде студенистого осадка обменными реакциями: Al2(SO4)3 + 6NaOH = 2Al(OH)3 + 3Na2SO4, или за счет добавления соды к раствору соли алюминия: 2AlCl3 + 3Na2CO3 + 3h3O = 2Al(OH)3Ї + 6NaCl + 3CO2, а также добавлением раствора аммиака к раствору соли алюминия: AlCl3 + 3Nh4·h3O = Al(OH)3Ї + 3h3O + 3Nh5Cl.
touch.otvet.mail.ru
Алюминий и его соединения СОДЕРЖАНИЕ Характеристика элемента
 Алюминий и его соединения
Алюминий и его соединения
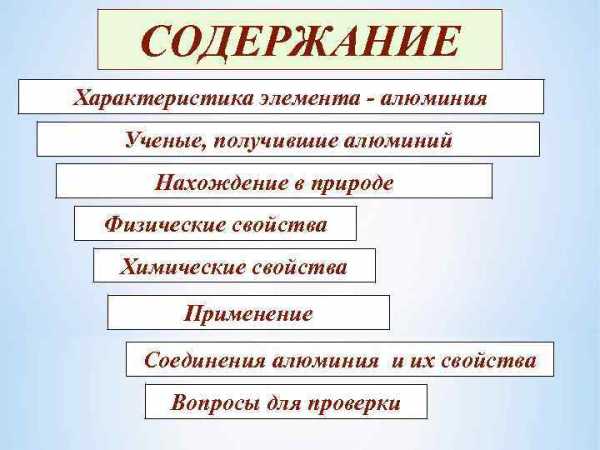 СОДЕРЖАНИЕ Характеристика элемента - алюминия Ученые, получившие алюминий Нахождение в природе Физические свойства Химические свойства Применение Соединения алюминия и их свойства Вопросы для проверки
СОДЕРЖАНИЕ Характеристика элемента - алюминия Ученые, получившие алюминий Нахождение в природе Физические свойства Химические свойства Применение Соединения алюминия и их свойства Вопросы для проверки
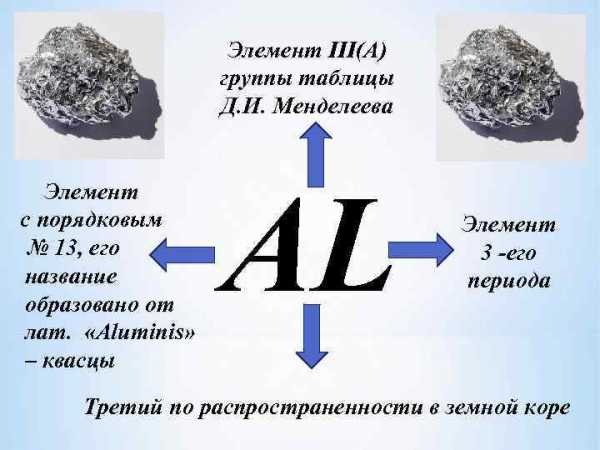 Элемент III(A) группы таблицы Д. И. Менделеева Элемент с порядковым № 13, его название образовано от лат. «Aluminis» – квасцы AL Элемент 3 -его периода Третий по распространенности в земной коре
Элемент III(A) группы таблицы Д. И. Менделеева Элемент с порядковым № 13, его название образовано от лат. «Aluminis» – квасцы AL Элемент 3 -его периода Третий по распространенности в земной коре
 Датский физик Ганс Эрстед (1777 -1851) Впервые алюминий был получен им в 1825 году действием амальгамы калия на хлорид алюминия с последующей отгонкой ртути.
Датский физик Ганс Эрстед (1777 -1851) Впервые алюминий был получен им в 1825 году действием амальгамы калия на хлорид алюминия с последующей отгонкой ртути.
 Современные метод получения был разработан независимо друг от друга: американцем Чарльзом Холлом и французом Полем Эру в 1886 году. Современное получение алюминия Он заключается в растворении оксида алюминия в расплаве криолита с последующим электролизом с использованием расходуемых коксовых или графитовых электродов.
Современные метод получения был разработан независимо друг от друга: американцем Чарльзом Холлом и французом Полем Эру в 1886 году. Современное получение алюминия Он заключается в растворении оксида алюминия в расплаве криолита с последующим электролизом с использованием расходуемых коксовых или графитовых электродов.
 Будучи студентом Оберлинского колледжа, Холл Чарльз он узнал, что можно разбогатеть и получить благодарность человечества, 1914) (1863 – если изобрести способ получения алюминия американский в промышленных масштабах. Как одержимый, Чарльз проводил эксперименты инженер-химик по выработке алюминия путем электролиза криолитно-глиноземного расплава. 23 февраля 1886 года спустя год после окончания колледжа Чарльз получил с помощью электролиза первый алюминий.
Будучи студентом Оберлинского колледжа, Холл Чарльз он узнал, что можно разбогатеть и получить благодарность человечества, 1914) (1863 – если изобрести способ получения алюминия американский в промышленных масштабах. Как одержимый, Чарльз проводил эксперименты инженер-химик по выработке алюминия путем электролиза криолитно-глиноземного расплава. 23 февраля 1886 года спустя год после окончания колледжа Чарльз получил с помощью электролиза первый алюминий.
 Поль Эру (1863 -1914) – французский инженер - химик В 1889 году открыл алюминиевый завод во Фроне (Франция), став его директором, он сконструировал электродуговую печь для выплавки стали, названную его именем; он разработал также электролитический способ получения алюминиевых сплавов
Поль Эру (1863 -1914) – французский инженер - химик В 1889 году открыл алюминиевый завод во Фроне (Франция), став его директором, он сконструировал электродуговую печь для выплавки стали, названную его именем; он разработал также электролитический способ получения алюминиевых сплавов
 Нахождение в природе им йш ня не од м аж сег ало я В а н нер ини я ми юм етс ал вля ит я окс б Осн хим овной иче ски ком й пон ент бок сит глин а озем (Al 2 (28 O 3) - 80 %).
Нахождение в природе им йш ня не од м аж сег ало я В а н нер ини я ми юм етс ал вля ит я окс б Осн хим овной иче ски ком й пон ент бок сит глин а озем (Al 2 (28 O 3) - 80 %).
 Физические свойства серебристо-белый с характерным металлическим блеском мягкий легкий (с малой плотностью – 2, 7 г/см 3) с высокой тепло- и электропроводностью легкоплавкий (температура плавления 660°C) ЭТО ВАЖНО: Занимает 1 -е место в земной коре среди металлов Совокупность этих важных свойств позволяет отнести алюминий к числу важнейших технических материалов
Физические свойства серебристо-белый с характерным металлическим блеском мягкий легкий (с малой плотностью – 2, 7 г/см 3) с высокой тепло- и электропроводностью легкоплавкий (температура плавления 660°C) ЭТО ВАЖНО: Занимает 1 -е место в земной коре среди металлов Совокупность этих важных свойств позволяет отнести алюминий к числу важнейших технических материалов
 Химические свойства Взаимодействие с простыми веществами: v с кислородом, образуя оксид алюминия: 4 Al + 3 O 2 = 2 Al 2 O 3 v с серой, образуя сульфид алюминия: 2 Al + 3 S = Al 2 S 3 v с азотом, образуя нитрид алюминия: 2 Al + N 2 = 2 Al. N v с углеродом, образуя карбид алюминия: 4 Al + 3 С = Al 4 С 3 v с хлором, образуя хлорид алюминия: 2 Al + 3 Cl 2 = 2 Al. Cl 3
Химические свойства Взаимодействие с простыми веществами: v с кислородом, образуя оксид алюминия: 4 Al + 3 O 2 = 2 Al 2 O 3 v с серой, образуя сульфид алюминия: 2 Al + 3 S = Al 2 S 3 v с азотом, образуя нитрид алюминия: 2 Al + N 2 = 2 Al. N v с углеродом, образуя карбид алюминия: 4 Al + 3 С = Al 4 С 3 v с хлором, образуя хлорид алюминия: 2 Al + 3 Cl 2 = 2 Al. Cl 3
 Химические свойства Взаимодействие со сложными веществами: 1. с водой (после удаления защитной оксидной пленки) 2 Al + 6 H 2 O = 2 Al(OH)3 + 3 H 2 2. с растворами щелочей (с образованием тетрагидроксоалюмината) 2 Al + 2 Na. OH + 6 H 2 O = 2 Na[Al(OH)4] + 3 H 2 3. c соляной и разбавленной серной кислотами: 2 Al + 6 HCl = 2 Al. Cl 3 + 3 H 2 2 Al + 3 H 2 SO 4(разб) = Al 2(SO 4)3 + 3 H 2 4. с оксидами менее активных металлов (алюминотермия) 8 Al + 3 Fe 3 O 4 = 4 Al 2 O 3 + 9 Fe 2 Al + Cr 2 O 3 = Al 2 O 3 + 2 Cr
Химические свойства Взаимодействие со сложными веществами: 1. с водой (после удаления защитной оксидной пленки) 2 Al + 6 H 2 O = 2 Al(OH)3 + 3 H 2 2. с растворами щелочей (с образованием тетрагидроксоалюмината) 2 Al + 2 Na. OH + 6 H 2 O = 2 Na[Al(OH)4] + 3 H 2 3. c соляной и разбавленной серной кислотами: 2 Al + 6 HCl = 2 Al. Cl 3 + 3 H 2 2 Al + 3 H 2 SO 4(разб) = Al 2(SO 4)3 + 3 H 2 4. с оксидами менее активных металлов (алюминотермия) 8 Al + 3 Fe 3 O 4 = 4 Al 2 O 3 + 9 Fe 2 Al + Cr 2 O 3 = Al 2 O 3 + 2 Cr
 В Авиации В Космической технике В Электротехнике В Судостроении В Строительстве Легкий сплав дюраль используется ПРИМЕНЕНИЕ В Автотранспорте АЛЮМИНИЯ в различных областях В быту
В Авиации В Космической технике В Электротехнике В Судостроении В Строительстве Легкий сплав дюраль используется ПРИМЕНЕНИЕ В Автотранспорте АЛЮМИНИЯ в различных областях В быту
 Оксид алюминия (AL 2 O 3) Соединения алюминия Гидроксид алюминия AL(OH)3
Оксид алюминия (AL 2 O 3) Соединения алюминия Гидроксид алюминия AL(OH)3
 Химические свойства оксида алюминия Амфотерный оксид Реагирует с кислотами AL 2 O 3 + 6 HCL=2 ALCL 3 + 3 H 2 O Реагирует с щелочами AL 2 O 3+ 2 Na. OH +3 H 2 O=2 Na[AL(OH)4]
Химические свойства оксида алюминия Амфотерный оксид Реагирует с кислотами AL 2 O 3 + 6 HCL=2 ALCL 3 + 3 H 2 O Реагирует с щелочами AL 2 O 3+ 2 Na. OH +3 H 2 O=2 Na[AL(OH)4]
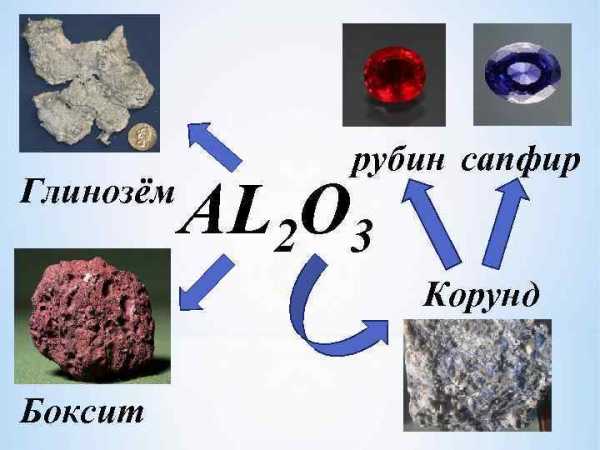 Глинозём рубин сапфир AL 2 O 3 Корунд Боксит
Глинозём рубин сапфир AL 2 O 3 Корунд Боксит
 Применение сапфиров знаменитые сапфиры английской королевской семьи
Применение сапфиров знаменитые сапфиры английской королевской семьи
 Применение рубинов
Применение рубинов
 Химические свойства гидроксида алюминия Амфотерный Разлагается при нагревании 2 AL(OH)3 = AL 2 О 3+ 3 H 2 O Реагирует с кислотами AL(OH)3 + 3 HCL = ALCL 3+ 3 H 2 O Реагирует с щелочами AL(OH)3 + Na. OH = Nа[AL(OH)4 ]
Химические свойства гидроксида алюминия Амфотерный Разлагается при нагревании 2 AL(OH)3 = AL 2 О 3+ 3 H 2 O Реагирует с кислотами AL(OH)3 + 3 HCL = ALCL 3+ 3 H 2 O Реагирует с щелочами AL(OH)3 + Na. OH = Nа[AL(OH)4 ]
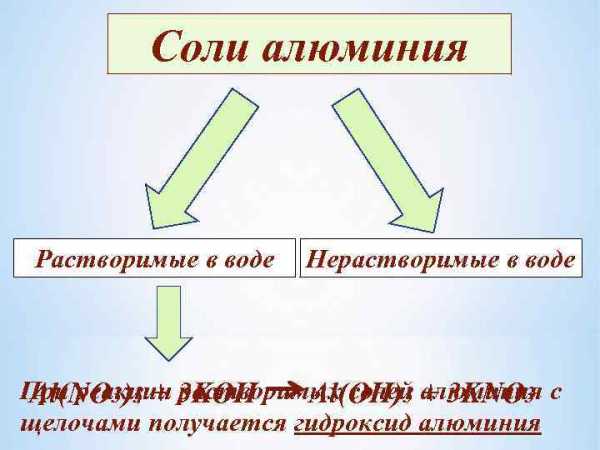 Соли алюминия Растворимые в воде Нерастворимые в воде При реакции 3 KOH Al(NO 3)3 + растворимых солей алюминия с Al(OH)3 + 3 KNO 3 щелочами получается гидроксид алюминия
Соли алюминия Растворимые в воде Нерастворимые в воде При реакции 3 KOH Al(NO 3)3 + растворимых солей алюминия с Al(OH)3 + 3 KNO 3 щелочами получается гидроксид алюминия
 Проверьте себя: Вставьте пропущенные слова в текст: Алюминий – это металл, у которого в соединениях степень окисления равна +3. В природе он встречается в виде оксида алюминия. Алюминий может вступать в реакцию с водой , образуя гидроксид алюминия, который обладает амфотерностью. Алюминий вступает в реакцию алюминотермии для восстановления менее активных металлов из их оксидов
Проверьте себя: Вставьте пропущенные слова в текст: Алюминий – это металл, у которого в соединениях степень окисления равна +3. В природе он встречается в виде оксида алюминия. Алюминий может вступать в реакцию с водой , образуя гидроксид алюминия, который обладает амфотерностью. Алюминий вступает в реакцию алюминотермии для восстановления менее активных металлов из их оксидов
 Какие из соединений вступят в реакцию с алюминием: Cl 2 K 2 O Cu. SO 4 H 2 O S Ba. SO 4 HCL Fe 2 O 3 Cr
Какие из соединений вступят в реакцию с алюминием: Cl 2 K 2 O Cu. SO 4 H 2 O S Ba. SO 4 HCL Fe 2 O 3 Cr
present5.com










