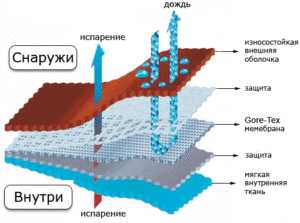
Аммиак это перекись водорода или нет
Чем отличается Аммиак от Перекиси водорода?

Все большую востребованность приобретают такие варианты, как:
- удаление воском;
- шугаринг;
- лазерное удаление.
Все современные новомодные способы имеют массу недостатков:
- процедуры в основном довольно болезненные;
- эффект после процедуры держится недолго, что приводит периодичностиданных операций;
- почти всегда возникает раздражение на коже;
- каждый из методов имеет свои побочные эффекты и противопоказания;
- большинство современных методов удаления волос доступно только при посещении специалистов.
Как лучше всего удалять нежелательные волосы

Как известно, пергидроль или Перекись водорода - это препарат, который используется в качестве антибактериального, антисептического средства. А нашатырь или аммиак используют чаще всего, чтобы привести человека в чувства. В основном его применяют в тех случаях, когда нужно срочно обработать кровоточащую рану. Но, помимо этого, это средство стали успешно применять для удаления и осветления нежелательных волосков.
Многие считают, что Перекись водорода и Аммиак одно и тоже, но это не так. Эти растворы применяют совместно для достижения максимального эффекта процедуры удаления растительности. Самый большой плюс использования такого средства - это долговременность эффекта, хоть волосы исчезают и не сразу, а только по прошествии некоторого времени.
Почему стоит применять именно перекись
Преимуществ у данного способа угнетения роста нежелательных волосков несколько.

К ним можно отнести такие, как:
- доступная цена на препарат, которая значительно ниже стоимости всех модныхпроцедур в салонах красоты;
- метод этот проверен временем, им пользуется уже не первое поколение;
- метод абсолютно безболезненный;
- после проведения процедуры не проявляются вросшие, раздражающие волосы;
- отдавая предпочтениеприменению Аммиака и Перекиси водорода, вы можете не бояться бактериальной инфекции;
- помимо удаления волос, происходит и отбеливание кожных покровов, что делает кожу более красивой и привлекательной;
- новые волоски, которые начнут расти на участках кожи, подвергнувшихся процедуре, будут более тонкими и светлыми, почти незаметными;
- при проведении нескольких процедур волоски совсем побледнеют и исчезнут, а процедуры можно будет прекратить.
Удаление волос на руках и ногах
Очень часто бывает, что на коже ног или рук растут некрасивые и темные волосы. Это особенно неприятно, если владелицей такой растительности является женщина. Если на лодыжках волосы можно и сбривать периодически, то на руках это уже слишком. Поэтому с такой непростой ситуации хорошим выходом будет высветление и вследствие этого последующее угнетение роста ненужных волосков с помощью перекиси водорода и аммиака.
Для этой процедуры будет необходимо:
- пара капсул аммиака;
- 25 мл воды;
- чайная ложечка пищевой соды;
- 25 мл перекиси водорода.
Перекись смешивается в емкости с водой, а после туда добавляется сода и аммиак. Необходимо проверить себя на аллергию посредством нанесения капли раствора на локтевой сгиб. Если проба результатов не дала и реакция не наступила, то можете смело наносить смесь на участок кожи с ненужными волосками. Подходите примерно 60 минут и смойте средство проточной водой с мылом. Если участки кожи чувствительны и нежны, то перед процедурой смажьте их детским кремом.
Удаление волос на лице

Так называемые усики у женщин - это настоящая проблема. Они, конечно, не всегда заметны, но бывает, что доставляют очень много неудобств. Но отчаиваться не стоит. Здесь тоже поможет раствор Аммиака и Перекиси водорода. Необходимо просто протирать место на лице, где есть нежелательные щетинки или волоски, раствором из аммиака и пергидроли. Со временем усики исчезнут.
Обесцвечивание волос с помощью Перекиси водорода
Навсегда забыть о надоедливых волосках на ногах, лице, животе, в зоне бикини поможет замечательная смесь, о которой говорилось выше. Осветление волос Перекисью водорода и Аммиаком или нашатырным спиртом набирает популярность с каждым днем, сдвигая с пьедестала дорогие и небезопасные процедуры у косметологов.
Если же говорить о волосах на голове, то тут тоже можно использовать данную смесь. При использовании раствора перед мытьем головы, женщина в скором времени станет блондинкой, волосы посветлеют, станут более мягкими и шелковистыми. Использовать данный водный раствор для волос на голове нужно предельно осторожно, не превышая концентрацию и не передерживая его на волосах. А лучше всего для головы использовать проверенные косметические средства, ведь потерять и испортить волосы в этом месте никто не захочет.
Источники:
Видаль: https://www.vidal.ru/drugs/hydrogen_peroxide__36359 ГРЛС: https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=598c3f69-91b2-45a1-8970-19bdc77500f8&t=
Нашли ошибку? Выделите ее и нажмите Ctrl + Enter
pillsman.org
Аммиак и перекись водорода — раствор аммиака, это случайно не перекись водорода? — 22 ответа
В разделе Наука, Техника, Языки на вопрос раствор аммиака, это случайно не перекись водорода? заданный автором Малосольный лучший ответ это это нашатырь
Ответ от Ђийна[гуру]нет, это - нашатырный спирт:)Ответ от Skniloff[гуру]Случайно нет, выпей яду.Ответ от Двутавровый[гуру]Ни в коем случае, абсолютно разные вещи!Ответ от росчерк[гуру]Нет это перекись водоаммиака.Ответ от [email protected][гуру]аммиак - нашатырный спирт перекись водорода - окислитель, штуки-то разныеОтвет от Ўрий[гуру]Аммиак - Nh4 перекись водорода - h3O2так что нет 🙂Ответ от Sergej Gritsenko[гуру]Нет, это нашатырный спирт!Ответ от Илья Зайцев[гуру]Нет. Растворы этих двух РАЗНЫХ веществ продаются в аптеке. Стоят около 10-15 рублей за пузырек. Так, что можешь убедиться сама, хотя бы по запаху. Потом еще можешь ради интереса пятнышко иода на чем-нибудь перекисью обесцветить.Ответ от Ўлия Симова[новичек]Да, а я зашла в аптеку спросила перекись. Мне фомоцевт дала амиак и на мой вопро что это, сказала что это одно и тоже. Вот так бывает.Пименова Кристина Руслановна на ВикипедииПосмотрите статью на википедии про Пименова Кристина Руслановна22oa.ru
Аммиак и нашатырный спирт: состав, разница, применение
Медицинские препараты позволяют справиться с проблемами, связанными со здоровьем, но иногда их используют в хозяйственных целях. К таким средствам можно отнести аммиак и нашатырный спирт. В быту эти препараты нашли широкое применение.
Существует мнение, что нашатырный спирт и аммиак – это одинаковые по своему составу вещества. Это не совсем так, поэтому следует разобраться во всем подробнее.
Отличия между нашатырным спиртом и аммиаком
К основному отличию аммиака от нашатырного спирта можно отнести их первоначальное агрегатное состояние. Аммиак – это газ, который сжижается при температуре -33 градуса по Цельсию. Что касается нашатырного спирта, то это вещество является жидкостью. К тому же подобное средство иногда называют раствором аммиака. Единственным сходством можно считать неприятный аммиачный запах.
Следует заметить, что для бытовых нужд нашатырный спирт получают путем смешивания воды и раствора аммиака. Для медицинских целей, процесс образования средства немного отличается и состоит из 2 ступеней. Сначала необходимо получить гидрат аммония, а затем из него изготовить нашатырный спирт.
Медицинские средства, используемые в быту
Нашатырный спирт и аммиак не единственные медицинские средства, которые можно использовать для хозяйственных целей. В быту хозяйками часто применяется хлорид аммония и перекись водорода.
Не все из указанных выше средств можно приобрести в аптечных пунктах. Например, нашатырь и аммиак продается только в специализированных магазинах или отделах бытовой химии. Следует заметить, что состав, а также процесс получения этих препаратов отличается друг от друга. Это можно увидеть, обратив внимание на формулу каждого вещества.
Разберемся с химическими формулами
Люди, не разбирающиеся в химии, считают, что нашатырный спирт, нашатырь, аммиак и перекись водорода – это похожие по своему составу вещества. На самом деле все не совсем так. Конечно, некоторые из препаратов имеют одинаковый запах, но они отличаются химической формулой, а также способом получения.
Что касается нашатыря, то его внешний вид напоминает порошок белого цвета. Нашатырный спирт имеет внешнее сходство лишь с перекисью водорода. Хотя по своему составу они также отличаются.
Формула аммиака
Аммиак – это бесцветный газ, имеющий резкий запах. Химически, подобное вещество записывается следующей формулой: Nh4. Температура плавления газа составляет -77,73 градуса по Цельсию. Что касается температуры кипения, то она равна -33,34 градуса по Цельсию.
следующей формулой: Nh4. Температура плавления газа составляет -77,73 градуса по Цельсию. Что касается температуры кипения, то она равна -33,34 градуса по Цельсию.
Для получения аммиака промышленным способом, специалисты объединяют водород с азотом. Это можно записать следующей формулой: 3h3+N2=2Nh4.
В лабораторных условиях используется аммоний, на который воздействуют сильные щелочи.
Нашатырный спирт и его формула
В отличие от аммиака, нашатырный спирт является бесцветной жидкостью, имеющей резкий запах. Это вещество имеет следующую химическую формулу: Nh5OH. Иногда можно встретить и другую формулу: Nh4∙h3O. Подобная запись используется для 10% водного раствора аммиака. У многих людей возникает вопрос, почему водный аммиачный раствор получил название спирта. Все просто, с латинского языка слово «spiritus» означает испарение. Это же касается и нашатырного спирта. Если емкость оставить открытой, вещество быстро испарится.
Формула нашатыря
Хлорид аммония получают природным и химическим путем. Его формула записывается следующим образом: Nh5Cl.
Примечательно, но изготовлением нашатыря, люди занимаются издревле. Жители Древней Греции получали хлорид аммония путем возгонки сажи из дымохода печи, отапливаемой верблюжьими фекалиями.
В природе вещество можно встретить внутри трещин земной коры и рядом с вулканами. Обычно хлорид аммония похож на белый налет.
Формула перекиси водорода
Нет такого человека, которому бы не приходилось сталкиваться с перекисью водорода. Внешне, вещество напоминает бесцветную вязкую жидкость. При больших объемах средство принимает синеватый оттенок. К тому же вещество не имеет запаха и вкуса. Что касается химической формулы, то она записывается следующим образом: h3O2.
Пероксид водорода закипает при температуре 150,2 градуса по Цельсию.
Впервые вещество было получено в 1818 году химиком Л.Ж. Тенаром. Он смешал азотную кислоту с пероксидом бария.
Как применяются вещества
Некоторые люди не знают, но такие вещества как перекись водорода и нашатырный спирт, а также порошок нашатыря и аммиак можно применять как в медицине, так и для хозяйственных целей.
Вышеперечисленные вещества можно применять:
- На даче;
- В качестве очистителей мебели;
- Для стирки;
- В косметологии;
- Как средства против насекомых.
Список можно перечислять до бесконечности, главное, знать пропорции и дополнительные вещества, чтобы сделать полезный препарат.
Как применять аммиак
Такое вещество, как аммиак, получило широкое распространение. Чаще всего, этот газ используется для получения удобрений. Его применяют для промышленных целей, а именно:
- В качестве нейтрализатора кислых отходов;
- Для создания капрона и нейлона;
- Для чистки и окраса хлопка, шерсти и шелка;
- В качестве хладагента для морозильных установок.
В домашних условиях вещество пригодится только для дачи, чтобы самостоятельно приготовить удобрения. Следует помнить о безопасности, поэтому все операции лучше проводить после того, как будет использован респиратор. Приобрести аммиак можно в специализированных магазинах.
Как применять аммиак водный
Аммиак водный или нашатырный спирт, используют как в медицине, так и в хозяйстве. Это средство способно привести потерявшего сознание человека в чувства. Достаточно открыть бутылочку нашатырного спирта, а затем смочить ватку, которую достаточно поднести к носу человека.
Иногда возникают ситуации, когда необходимо вызвать рвотный рефлекс. Для этого достаточно смешать 10 капель водного аммиачного раствора и 100 миллилитрами воды. Категорически запрещается глотать неразбавленный нашатырный спирт, иначе можно получить ожог пищевода или желудка. Применять нашатырный спирт необходимо только в крайних случаях и небольших количествах.
Еще одним полезным качеством нашатырного спирта является то, что он считается антисептиком. Именно поэтому хирурги перед операцией, обрабатывают им руки.Что касается быта, то аммиак водный позволяет очистить замшевые вещи. Для приготовления раствора понадобится 4 части чистой воды и 1 часть спирта. После смешивания, необходимо смочить ватный тампон, а затем протереть им загрязненный участок.
Как применяется хлорид аммония
Многие люди не знаю, но использование аммония хлористого позволят реализовать некоторые задачи в таких сферах, как:
- Машиностроение;
- Сельское хозяйство;
- Металлургия;
- Лесное хозяйство;
- Медицина;
- Химическая промышленность.
К тому же это вещество может быть использовано как пищевая добавка «E510». В основном она добавляется в дрожжи, соусы и мучные изделия. Следует заметить, что использование нашатыря в качестве пищевой добавки запрещено во многих странах ЕС. Это связано с тем, что вещества, входящие в его состав, могут причинить вред здоровью.
Как применяется перекись водорода
Такое вещество как перекись водорода широко применяется в медицине, а также хозяйстве. Благодаря своему составу, препарат позволяет нейтрализовать многие заболевания. Конечно, следует учесть то, что его применяют совместно с другими препаратами и веществами.
Что касается быта, то перекись позволяет справиться с загрязнениями и неприятным запахом. Многие хозяйки используют вещество для мытья холодильника. Если будет использовано подобное средство, разница будет ощутимой, так как от запаха не останется и следа.Если под руками нет отбеливателя, а он катастрофически необходим, можно сделать его самостоятельно. Достаточно добавить в моющее средство 200 миллилитров 3% раствора перекиси.
dombrat.ru
ПОИСК
Аммиак + перекись водорода. [c.109]В рамках данного проекта проводятся исследования перспективного метода синтеза циклогексаноноксима - исходного продукта в производстве е-капролактама окислительным аммонолизом циклогексанона. Реакция окислительного амманолиза осуществляется при взаимодействии циклогексанона с аммиаком и перекисью водорода при 10-20°С. В качестве катализатора нами использовались растворимые в водной фазе соединения вольфрама. Стабилизация распада перекиси водорода осуществлялась с помощью трилона-Б Было установлено, что при молярном соотношении циклогексанон перекись водорода аммиак = 14 5 выход циклогексаноноксима составляет 93-95% на загруженный циклогексанон при практически полной его конверсии. С целью выяснения механизма реакции окислительного аммонолиза циклогексанона была изучена кинетика процесса и показано, что он протекает через промежуточное образование гидропероксициклогексиламина Для получения циклогексанона и перекиси водорода предложено использовать жидкофазное окисление цикJюгeк aнoлa В зтой связи подробно изучена реакция окисления циклогексанола - температура, продолжительность реакции, концентрация катализатора, выделение смеси циклогексанона и перекиси водорода, которая непосредственно была использована для получения циклогексаноноксима. Изучена кинетика реакции окислительного аммонолиза циклогексанона и предложен механизм реакции [c.53]
Помимо воды и некоторые другие жидкости могут служить ионизирующими растворителями электролитов с образованием растворов, проводящих электрический ток. К таким жидкостям относятся перекись водорода, фтористый водород, жидкий аммиак и цианистый водород. Подобно воде, все эти жидкости имеют большую диэлектрическую проницаемость. Жидкости с малой диэлектрической проницаемостью, такие, как бензол или сероуглерод, не являются ионизирующими растворителями. [c.259]О к исленйе пиридоксин -5а- фосфата и пиридоксамин-5а-фосфата в пиридоксаль -5а- фос-ф а т. Реакцию катализирует пиридоксаминфосфатоксидаза с простетической группой ФМН [447]. При окислении пиридоксамин-5а-фосфата в пиридоксаль-5а-фосфат выделяется аммиак и перекись водорода [c.566]
В понятие химические реактивы включаются многочисленные химические соединения, с которыми имеют дело в аналитической лаборатории кислоты, щелочи, аммиак, перекись водорода и другие общеупотребительные соединения. Более важны специальные неорганические и органические реактивы, причем органические приобрели большее значение. Если реактив используется как активное начало в химико-аналитической реакции (осадитель, реактив, дающий окрашенный или экстрагируемый комплекс с определенным металлом), его часто называют реагентом. Этот термин, например, утвердился в тех областях аналитической химии, которые имеют дело с органическими реактивами для фотометрического анализа. Однако, когда говорят о производстве, о продаже или наличии реактивов в широком масштабе, используют термин реактив . Уместно оказать я получил на складе много новых реактивов , но он изучает теорию действия органических реагентов и т. п. Различие это появилось относительно недавно и, кажется, только в русском языке. [c.167]
Помимо этих постоянных компонентов воздух содержит 0,03 объемн. % СОг. Водород, аммиак, перекись водорода и все инертные газы (за исключением аргона) вместе составляют 0,01%. [c.256]
Карбонат аммония, насыщенный раствор в 2 н. аммиаке. Перекись водорода, 3%-ная. Раствор не должен давать окраски с карбонатом аммония. Лучше всего готовить его разбавлением 30%-ного раствора. [c.353]
Реакция (2) происходит без участия фермента, так как иминокислоты очень неустойчивы в водном растворе и расщепляются с образованием а-кетокислот и аммиака. Перекись водорода, получающаяся в реакции (3), в тканях распадается на воду и на кислород под влиянием каталазы. [c.346]
В оставшийся раствор добавили перекись водорода для перевода железа из двух- в трехвалентное состояние, затем избыток перекиси удалили кипячением. После добавления раствора гидроокиси аммония выпал осадок гидроокиси железа. Гидроокись цинка растворима в избытке аммиака вследствие образования комплексного соединения. [c.180]
Оборудование и реактивы. Коническая колба на 250 мл. Мерная колба иа 100 мл. Мерные цилиндры. Водяная баня. Микробюретка. Фильтр ФКП 60-ПОР 10-90 по ГОСТ 9775—69. Перекись водорода (пергидроль, 30%-ный раствор). Аммиак (25%-ный раствор). Соляная кислота (5,0 н.). Изоамиловый спирт. Роданид аммония (10%-ный раствор). Дистиллированная вода. Эталонный раствор соли железа (III), содержащий 0,00001 г железа в 1 мл. [c.155]
В полумикропробирку помещ,ают раствор сульфата железа (И) или соли Мора, каплю уксусной кислоты, 2 капли диметилглиоксима и по каплям — аммиак. Получается розовое окрашивание. Добавляя по каплям 3%-ную перекись водорода, разрушают окраску. [c.217]
Рибофлавин в больших концентрациях и в растворах с низким значением pH более устойчив к действию света, чем при низких концентрациях в щелочных условиях. Аскорбиновая кислота, чайный танин способны замедлять разрушение рибофлавина. Рибофлавин устойчив к кислотам, брому и к таким окислителям, как перекись водорода и концентрированная азотная кислота. Хромовая кислота окисляет его до аммиака, углекислоты и азота [61. Рибофлавин в естественных источниках сырья связан в значительной части с белком связь эта расщепляется проТеолитическими ферментами [181. [c.109]
Некоторые из предлагавшихся в разное время реагентов кратко рассмотрены нами в разделе Весовые методы определения . Большинство из них не обладает никакими преимущ,ествами перед рядом более простых и доступных реагентов или являются даже менее эффективными. Так, например, ш елочные цианиды [569], предложенные для осаждения.урана (VI), обладают меньшими возможностями для отделения урана (VI) от других элементов по сравнению даже с такими простыми реагентами, как. аммиак, едкие щелочи, перекись водорода или карбонаты щелочных металлов и аммония. [c.283]
Другие растворы электролитов. Наряду с водой и другие жидкости могут служить в качестве ионизирующих растворителей, в которых растворяются электролиты, образуя проводящие растворы. К числу таких ншдко-стей относится жидкий аммиак, перекись водорода, фтористый водород. Все такие жидкости, подобно воде, имеют очень высокую диэлектрическую проницаемость, благодаря чему образуемые ими ионные растворы характеризуются сильным взаимодействием между электрическими зарядами ионов и молекулами растворителя, а это стабилизирует ионные растворы. Жидкости с низкой диэлектрической проницаемостью, такие, как бензол и сероуглерод, не являются ионизирующими растворителями. [c.170]
Изменения энтальпии при образовании стехиометрической смеси ионов в неводных и смешанных растворителях находят обычно из термохимических данных. Для этой цели определяют тепловые эффекты процессов,с участием сольватированных ионов (растворение, обменные реакции и другие), а затем элементарным пересчетом получают искомые величины. При решении этой задачи чаш е всего используют данные об изменении энтальпии при растворении соединения. К настоящему времени они известны для ряда солей с одноатомными, многоатомными и комплексными ионами (в основном, галогениды, нитраты, перхлораты щелочных и щелочноземельных металлов) приблизительно в двадцати неводных и пятнадцати смешанных растворителях. Неводные растворители охватывают различные классы веществ одноатомные и многоатомные спирты, кислоты, эфиры, кетоны, амиды, аммиак, перекись водорода и т. п. Смешанные растворители представляют собой смеси указанных растворителей с водой и, частично, смеси органических растворителей. Поскольку вопрос о величинах А Граств соединений в неводных и смешанных растворителях будет обсужден специально в последующих главах, мы на нем здесь больше не останавливаемся. [c.98]
Мази в виде гетерогенных систем, которые состоят из двух фаз и имеют поверхность раздела, называкуг эмульсионными. Эмульсионные мази, линименты, кремы готовят, в случае когда с гидрофобной мазевой основой прописаны небольшие количества водорастворимых лекарственных веществ (кроме резорцина и цинка сульфата), водные растворы лекарственных веществ и вьггяжки (жидкость Бурова, раствор аммиака, перекись водорода, раствор кальция хлорида, отвары, настои), а также этиловый спирт, глицерин, димексид или когда вместе с гидрофильными мазевыми основами прописаны гидрофобные жидкости (вршилин, деготь, нафталан и т.д.). [c.263]
Данные методы предназначены для определения летучих органических хлоридов в концентрации от 10 до 100 ppm в бутан-бутеновых смесях. Амперометрическое титрование не может быть непосредственно применено в присутствии веществ, которые взаимодействуют с ионом серебра или с хлороксидными ионами в разбавленном растворе кислоты. Бромиды, сульфиды, аммиак, табачный дым и перекись водорода в количестве более 25 мкг в анализируемом растворе мешают спектрофотометрическому определению. [c.24]
Следует отметить, что в щелочных растворах гипобромиты окисляют иодид-ионы до иодат-ионов [581, с. 158], сульфид- и тиосульфат-ионы — до сульфат-ионов [261, с. 85], нитрит-ионы до нитрат-ионов, арсенит-ионы до арсепат-ионов [276, 610], аммиак, соли аммония и мочевину — до азота [261, 612], перекись водорода до кислорода [463], причем ВгО восстанавливается до Вг . Сомнения по поводу полноты окисления выражались только по отношению к реакции [c.30]
Для работы требуется Аппарат Киппа для получения сероводорода с осушительными склянками (с СаС12). — Прибор (сл1. рис. 55). — Пробка с газоот-ввдной трубкой, согнутой под прямым углом. — Штатив с пробирками. — Стакан амк. 100 мл. — Цилиндры со стеклами 2 шт. — Цилиндр мерный емк. 50 мл. — Пипетка емк. 10 мл. — Кристаллизатор большой. — Воронка. — Шпатель стеклянный. — Палочки стеклянные, 2 шт. — Ложечка для сжигания. — Двуокись марганца. — Хлорид меди. — Бромид калия. — Окись ртути. — Перекись натрия. — Перекись бария. — Железо (опилки). — Хлорид кобальта. — Сера кусковая. — Серная кислота, 2 н. раствор. — Бихромат калия, 1 н. раствор. — Иодид калия, 0,5 н. раствор. — Сульфид натрия, 1 н. раствор. — Сульфат натрия, 0,5 и. раствор. — Хлорид натрия, 0,5 н. раствор. — Нитрат серебра, ]%-ный )аствор. — Хлорид бария, 0,5 н. раствор. — Раствор фуксина, 1%-ный.— г итрат свинца, 0,5 н. раствор. — Хромит натрия, 0,1 н. раствор. — Едкий натр, 2 и. раствор. — Перманганат калия, 0,05 и. и 2 М растворы. — Аммиак, 5%-ный раствор. — Растворы лакмуса, фенолфталеина и метилового оранжевого. — Перекись водорода, 3%-ный раствор. — Ацетон. — Эфир.—Снег (лед).—Спирт этиловый. — Ткань окрашенная. — Бумага фильтровальная. — Лучины. — Песок. [c.164]
Разложения и соединения, которые происходят таким образом, встречаются очень часто мы будем, — писал Э. Митчерлих, — называть их разложением и соединением через контакт... Прекрасным примером служит окисленная вода (перекись водорода) малейшие количества перекиси марганца, золота, серебра и других веществ разлагают это соединение иа воду и кислород — газ, который выделяется, причем эти вещества не претерпевают пи малейшего изменения. Сюда же нрипадлея ит распадение сахаристых Benie TB на алкоголь и углекислоту, окисление алкоголя при его превращении в уксусную кислоту, распадение мочевины и воды на угольную кислоту и аммиак. Сами по себе эти вещества не претерпевают никакого изменения, но после прибавления малых количеств фермента, который прп этом является контактным веществом, нри известной температуре, это (т. е. препра1цение) происходит тотчас я е. Превращение крахмала в крахмальный сахар при [c.349]
В физико химическом методе измерения капелек водяного тумана по следние осаждают на прозрачную пленку нз ацетата целлюлозы покрытую слоем поливинилового спирта содержащего нитрат серебра и перекись водорода Затем пленку обрабатывают парами фенилгидразина аммиаком и водяным паром и облучают ультрафиолетовым светом На ней появляются отпечатки капелек с резкими контурами Размер капелек определяется по калибровочной кривон [c.243]
Определению калия в виде перхлората мешают сульфаты, так как сульфат натрия мало растворим в применяемых органических растворителях и может увеличивать вес остатка перхлората калия [936, 1271, 1476, 1862, 2460, 2488] Поэтому анализируемый раствор сильно подкисляют соляной кислотой и по каплям прибавляют 10%-ный раствор ВаСЬ в небольшом избытке Калий определяют в фильтрате от осадка Ва304. Сульфаты удаляют обработкой раствором оксалата бария в соляной кислоте, затем добавляют перекись водорода и аммиак В осадке находятся сульфат бария, оксалаты щелочноземельных металлов, гидроокиси железа, алюминия, марганца. Фильтрат выпариваю г досуха, прокаливают, извлекают водой и осаждают перхлорат калия [2511] Удаляют сульфат из нейтрального раствора кипячением с ВаСОз, при этом осаждается также и магний [2978] [c.31]
Не вызывает затруднений получение перрената аммония из сульфида рения (если рений осаждается в виде Ке257) Для этого осадок обрабатывают аммиаком, добавляя перекись водорода [112] [c.311]
Впоследствии ввиду отмеченных выше существенных недостатков полимеризации в блоке коллидон стали получать полимеризацией в растворе. Инициатором являлась перекись водорода в качестве активатора добавляли аммиак. [c.83]
Продажный перренат калия измельчают до 60 меш и растворяют в горячей 10-процент.ной соляной кислоте. На каждый грамм рения берут приблизительно 100 мл кислоты. В раствор пускают сильный ток водорода до тех пор, пока выделившийся сульфид не скоагулирует. Осадок собирают на асбестовой прокладке или на воронке Бюхнера [3], хорошо промывают раствором сероводорода и затем дестиллированной водой. Сульфид вместе с асбестовой прокладкой переносят в стакан с водой, содержащей аммиак ( 0% по весу). На каждый грамм перрената калия берут 25 мл этого раствора. Суспензию нагревают до 40° и прибавляют 30-процентную перекись водорода до тех пор, пока черный сульфид целиком не окислится и раствор не станет бесцветным. Асбест отфильтровывают, и раствор упаривают досуха на водяной бане. Остаток растворяют в горячей воде. К раствору добавляют несколько капель азотной кислоты и нагревают его до кипения для коагуляции небольших количеств выпадающей при этом двуокиси кремния. После фильтрования к раствору добавляют немного аммиака и упаривают досуха. Продукт, состоящий из перрената аммония и азотнокислого аммония, сушат при П0°, переносят в кварцевую лодочку и восстанавливают в кварцевой трубке сильным током сухого водорода. Температуру нужно поднимать медленно, чтобы избежать потери вследствие возгонки . Окончательное восстановление ведут при 1000° в течение 2 час. После охлаждения в токе азота продукт можно извлечь из трубки, где велось восстановление. Выход — 80—90% в расчете на KRe04 чистота рения, приготовленного этим способом,— около 100%. По внешнему виду он похож на металл, в отличие от порошкообразного рения, полученного пря-мьгм восстановлением перрената калия. [c.171]
Первая (1), анаэробная, стадия характеризуется образованием альдегида, аммиака и восстановленного фермента. Последний в аэробной фазе окисляется молекулярным кислородом. Образовавшаяся перекись водорода далее распадается на воду и кислород. Моноаминоксидаза (МАО), ФАД-содержащий фермент, преимущественно локализуется в митохондриях, играет исключительно важную роль в организме, регулируя скорость биосинтеза и распада биогенных аминов. Некоторые ингибиторы моно-аминоксидазы (иираниазид, гармин, иаргилин) используются ири лечении гипертонической болезни, депрессивных состояний, шизофрении и др. [c.446]
chem21.info